醫療器械注冊單元劃分概述——注冊單元劃分常見問題解答
從事醫療器械注冊的小伙伴們可能都為同一個問題苦惱過,那就是醫療器械注冊單元的劃分。企業所設計開發出的產品,其所包含的產品范圍,是否可通過一個注冊單元完成注冊,從而
來源:醫療器械注冊代辦 發布日期:2023-10-10 閱讀量:次
?

1.試驗用醫療器械的研制應當符合適用的醫療器械______相關要求。
A.質量管理體系
B.風險管理
C.經營管理體系
D.使用管理體系
2.多中心臨床試驗的臨床試驗報告應當包含各分中心的臨床試驗_____
A.報告
B.小結
C.資料
D.電子文檔
3.經充分和詳細解釋后由受試者或者其監護人在知情同意書上簽署姓名和日期,____也需在知情同意書上簽署姓名和日期。
A.研究者
B.申辦者
C.醫務人員
D.研究人員
4.受試者或者其監護人均無閱讀能力時,在知情過程中應當有一名____在場,經過詳細解釋知情同意書后,___-閱讀知情同意書與口頭知情內容一致,由受試者或者其監護人口頭同意后,____在知情同意書上簽名并注明日期,_____的簽名與研究者的簽名應當在同一天;
A.見證人
B.申辦者
C.病人
D.親屬
5.醫療器械分類,按照風險由高到低分為:
A.一類、二類、三類
B.三類、二類、一類
C.A類、B類、C類
D.C類、B類、A類
6.申辦者決定暫停或者終止臨床試驗的,應當在__日內通知所有臨床試驗機構醫療器械臨床試驗管理部門,并書面說明理由。
A.5
B.10
C.15
D.20
7.對暫停的臨床試驗,未經_____同意,不得恢復。
A.倫理委員會
B.申辦者
C.研究者
D.臨床試驗機構
8.保障受試者權益的主要措施有
A.倫理審查與知情同意
B.倫理審查
C.知情同意
D.倫理審查或知情同意
9.在多中心臨床試驗中,申辦者應當保證_____的設計嚴謹合理,能夠使協調研究者獲得各分中心臨床試驗機構的所有數據。
A.病例報告表
B.核查表
C.檢查報告
D.監查報告
10.對于多中心臨床試驗,申辦者應當保證在臨床試驗前已制定文件,明確_____和其他研究者的職責分工。
A.協調研究者
B.申辦者
C.研究者
D.臨床試驗機構
11.列入需進行臨床試驗審批的第__醫療器械目錄的,還應當獲得國家藥品監督管理局的批準。
A.三類
B.一類
C.二類
12.____在接受臨床試驗前,應當根據試驗用醫療器械的特性,對相關資源進行評估,以決定是否接受該臨床試驗。
A.藥品監督管理部門
B.申辦者
C.研究者
D.臨床試驗機構
13.受試者有權在臨床試驗的___階段退出并不承擔任何經濟責任。
A.臨床試驗開始
B.中間階段
C.結束
D.任何
14.臨床試驗機構、研究者、申辦者應當建立基本文件____制度
A.修改
B.保存
C.檢查
D.分析
15.臨床試驗前,申辦者應當向所在地省、自治區、直轄市藥品監督管理部門_____。
A.注冊
B.備案
C.辦理審批手續
D.通知
16.倫理委員會應當從保障_____權益的角度嚴格審議試驗方案以及相關文件。
A.申辦者
B.研究者
C.臨床試驗機構
D.受試者
17.國產醫療器械開展臨床試驗,申辦者通常為醫療器械______
A.生產企業
B.經營企業
C.使用機構
D.個人
18.臨床研究中,必須確保因參與研究而受傷害的受試者得到適當的__和__
A.安撫、補償
B.補償、治療
C.治療、安撫
D.安撫、慰問
19.所選擇的試驗機構應當是____醫療器械臨床試驗機構,且設施和條件應當滿足安全有效地進行臨床試驗的需要。
A.無需資質認定的
B.二級以上
C.經備案的
D.三級以上
20.需要審批的醫療器械臨床試驗應當在批準后__年內實施;逾期未實施的,原批準文件自行廢止,仍需進行臨床試驗的,應當重新申請。
A.3
B.4
C.5
D.6
1.臨床試驗機構和研究者應當確保臨床試驗所形成__、___和___的真實、準確、清晰、安全
A.數據
B.文件
C.記錄
D.資料
2.醫療器械臨床評價是指申請人或者備案人通過臨床____、臨床______、_____等信息對產品是否滿足使用要求或者適用范圍進行確認的過程。
A.文獻資料
B.經驗數據
C.臨床試驗
D.數據
3.最小風險(Minimal Risk),指試驗風險的可能性和程度不大于__或進行__或__的風險
A.日常生活
B.常規體格檢查
C.心理測試
D.手術
4.參與醫學研究的醫生有責任保護受試者的__?
A.生命、健康
B.自主決定權
C.隱私和個人信息
D.尊嚴、公正
5.當研究涉及__或__上不具備知情同意能力的受試者時(比如無意識的患者),只有在阻礙知情同意的身體或精神狀況正是研究目標人群的一個必要特點的情況下,研究方可開展。
A.家庭環境
B.身體
C.精神
D.病情
6.負責臨床試驗的研究者應當具備條件有哪些?
A.相關專業技術職稱和資質并具有專業知識和經驗,必要時應當經過有關培訓;
B.熟悉申辦者要求和其所提供的與臨床試驗有關的資料、文獻
C.有能力協調、支配和使用進行該項試驗的人員和設備,且有能力處理試驗用醫療器械發生的不良事件和其他關聯事件
D.熟悉國家有關法律、法規以及本規范
7.嚴重不良事件,是指臨床試驗過程中發生的導致死亡或者健康狀況嚴重惡化,包括:
A.需住院治療或者延長住院時間
B.身體結構或者身體功能的永久性缺陷
C.致命的疾病或者傷害
D.需要進行醫療或者手術介入以避免對身體結構或者身體功能造成永久性缺陷
8.對于多中心臨床試驗,各分中心臨床試驗小結應當至少包括_____、______、______、_____、方案偏離情況說明等,并附病例報告表。
A.臨床試驗概況
B.臨床一般資料
C.試驗用醫療器械以及對照用醫療器械的信息描述、安全性和有效性數據集
D.不良事件的發生率以及處理情況
9.未在境內外批準上市的新產品,____以及___尚未經醫學證實的,臨床試驗方案設計時應當先進行小樣本可行性試驗,待初步確認其安全性后,再根據統計學要求確定樣本量開展后續臨床試驗。
A.療效
B.安全性
C.性能
D.不良反應
10.研究者應當保證將臨床試驗數據________________地載入病例報告表。
A.準確、完整
B.工整、嚴肅
C.清晰、及時
D.不可修改
1.在受試者參與臨床試驗前,研究者應當充分向受試者或者無民事行為能力人、限制民事行為能力人的監護人說明臨床試驗的詳細情況,包括已知的、可以預見的風險和可能發生的不良事件等。
正確
錯誤
2.研究者,是指在臨床試驗機構中負責實施臨床試驗的人。如果在臨床試驗機構中是由一組人員實施試驗的,則研究者是指該組的負責人,也稱主要研究者。
正確
錯誤
3. 倫理委員會中獨立于研究者和申辦者的委員無權發表意見并參與有關試驗的表決。
正確
錯誤
4.倫理委員會在審查某些特殊試驗時,可以邀請相關領域的專家參加。
正確
錯誤
5.醫療器械臨床試驗,是指在經資質認定的醫療器械臨床試驗機構中,對擬申請注冊的醫療器械在正常使用條件下的安全性和有效性進行確認或者驗證的過程。
正確
錯誤
6.臨床試驗應當獲得醫療器械臨床試驗機構倫理委員會的同意。列入需進行臨床試驗審批的第二類醫療器械目錄的,還應當獲得國家藥品監督管理局的批準。
正確
錯誤
7.多中心臨床試驗的倫理審查應當由牽頭單位倫理委員會負責建立協作審查工作程序,保證審查工作的一致性和及時性。
正確
錯誤
8.臨床數據,是指在有關文獻或者醫療器械的臨床使用中獲得的安全性、性能的信息。
正確
錯誤
一:ABAAB,AAAAA,ADDBB,DABCA,
二:ABC,ABC,ABC,ABCD,BC
ABCD,ABCD,ABCD,BC,AC,
三:對對錯對對
錯對對對對
對錯錯對對
對錯對對對

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

從事醫療器械注冊的小伙伴們可能都為同一個問題苦惱過,那就是醫療器械注冊單元的劃分。企業所設計開發出的產品,其所包含的產品范圍,是否可通過一個注冊單元完成注冊,從而
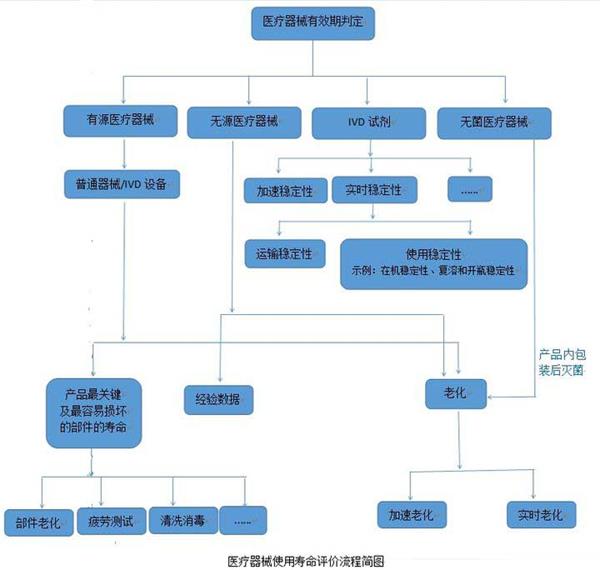
醫療器械的使用壽命是指醫療器械從規劃、設計、生產、銷售、安裝調試到使用、維修、維護檢測、報廢的全過程。而醫院使用的醫療器械的應用質量和安全管理在整個壽命過程中占重

臨床研究協調員(全稱Clinical Research Coordinator,簡稱CRC):指經主要研究者授權,在臨床試驗中協助研究者進行非醫學性的相關事務性工作,是臨床試驗的參與者。 臨床試驗現場管理組

隨著醫療器械出口的日益增長,根據市場的需求各醫療器械生產廠商需要符合國家和地區的質量體系法規越來越多,所以經常會碰到出處于不同法規或標準的一些比較容易混淆的概念及

剛接觸醫療器械CRO行業的小伙伴,在學習文件法規資料的同時,常看到一些英文類專業名詞不知道是什么意思。下面,一起看看常見的醫療器械臨床試驗專業術語......"

醫療器械注冊證是依照法定程序,對擬上市銷售、使用的醫療器械的安全性、有效性進行評價,決定同意其銷售、使用后發放的證件,由國家食品藥品監督管理總局統一制定。"

2019年5月31日,國家藥監局發布了《關于實施醫療器械注冊電子申報的公告(2019年第46號)》,從2019年6月24日正式實施電子申報,從11月1日起提交國家局的注冊資料都需要按照電子申報目錄

CRC的能力提高能提升與CRA的工作配合度,也能提高項目的質量并加快項目進度。同時CRC的水平提高也成就了CRC-CRB-CRA的轉變。CRC的工作效率也直接關系到CRA的工作效率,比如方案修正案遞

隨著越來越多的臨床試驗中都配備 CRA,CRA 與 CRC 在臨床試驗中的作用及合作值得大家一起探討。首先,介紹一下在項目運行中可能出現的問題和矛盾,間接影響了項目的執行和質量。希
眾所周知,醫療器械分為三類,一類采用備案制,二三類采用注冊制管理,等級越高,管理越嚴格。一類醫療器械都是免臨床的,因此備案工作比較簡單不繁瑣。而二三類醫療器械除免臨床產品
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
