各地醫療器械注冊收費標準匯總(截至2022年1月5日)
醫療器械注冊費是行政性收費,按照注冊單元收取,部分省份不收取醫療器械注冊費用,絕大部分省份還是收取的。本篇文章統計了截止到2022年1月5日各地醫療器械注冊收費標準。
來源:醫療器械注冊代辦 發布日期:2023-10-10 閱讀量:次
?

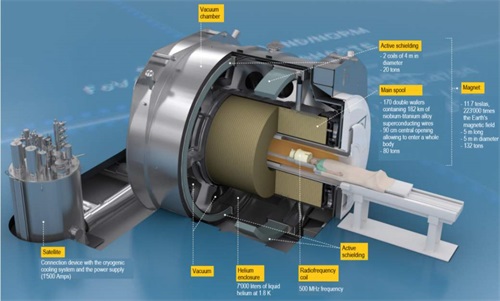
FDA于2020.12.11發布了關于簡短(Abbreviated) 510(k)申請的相關產品指南,該指南是在遵守“基于安全有效性途徑”這一前提下編制提出的。在這個框架下,申請人若計劃使用安全有效性途徑提交一份關于磁共振線圈產品的510 (k)申請,可以選擇使用本指南中建議的性能指標來證明與等同產品的實質性等同,而不用比較兩者的其他更多性能參數。

本指南適用的磁共振線圈用于為經過專業培訓的的臨床醫生制作人體解剖學圖像,以用于一般診斷。其屬第II類器械,對應法規條款為21 CFR 892.1000,產品代碼為MOS(線圈、磁共振、專用)。
●試驗名稱:圖像信噪比
方法:符合以下FDA認可的共識標準之一(如適用):
●IEC 62464-1 Magnetic resonance equipment for medical imaging - Part 1:Determination of essential image quality parameters
●National Electrical Manufacturers Association (NEMA) MS 1 Determination of Signal-to-Noise Ratio (SNR) in Diagnostic Magnetic Resonance Imaging
●NEMA MS 6 Determination of Signal-to-Noise Ratio and Image Uniformity for Single-Channel, Non-Volume Coils in Diagnostic Magnetic Resonance Imaging (MRI)
●NEMA MS 9 Characterization of Phased Array Coils for Diagnostic Magnetic Resonance Images (MRI)
性能標準:>130(適用于1.5T線圈),>215(適用于3T線圈)(使用對所有成像線圈、平面和解剖區域的最低信噪比測量)
●試驗名稱:圖像均勻性
方法:符合以下FDA認可的共識標準之一(如適用):
●IEC 62464-1 Magnetic resonance equipment for medical imaging - Part 1:Determination of essential image quality parameters
●NEMA MS 3 Determination of Image Uniformity in Diagnostic Magnetic Resonance Images
●NEMA MS 6 Determination of Signal-to-Noise Ratio and Image Uniformity for Single-Channel, Non-Volume Coils in Diagnostic Magnetic Resonance Imaging (MRI)
●NEMA MS 9 Characterization of Phased Array Coils for Diagnostic Magnetic Resonance Images (MRI)
性能標準:最壞情況下的不均勻性<50% (例如,不應用任何可選的軟件校正算法)
●試驗名稱:表面加熱
方法:符合以下FDA認可的共識標準之一(如適用):
●NEMA XS 14 Characterization of Radiofrequency (RF) Coil Heating in Magnetic Resonance Imaging Systems
性能標準:根據ANSI/AAMI ES 60601-1 -1所定義的溫度標準:<41℃,適用于正常使用和單故障(線圈未插接)情況。
●試驗名稱:獲得的圖像質量
方法:對所有目標解剖位置的臨床圖像進行檢查,以確定該產品產生的圖像對于診斷使用是足夠高質量的。
性能標準:來自美國委員會認證或國際同等資歷的醫生(如放射學家、放射腫瘤學家)的聲明,說明圖像具有診斷質量,臨床樣本圖像證明該線圈有生成診斷質量圖像的能力。
●試驗名稱:去耦電路
方法:電路圖檢查
性能標準:存在解耦機制
●試驗名稱:電磁兼容(EMC) -抗靜電放電
方法:FDA目前認可的IEC 60601-1-2版本Medical electrical equipment - Part 1-2:General requirements for basic safety and essential performance - Collateral Standard:Electromagnetic disturbances - Requirements and tests
性能標準:在以±8 kV 接觸,和±2 kV,±4 kV,±8 kV,±15 kV 空氣影響時都能通過
●試驗名稱:通用電氣/機械安全
方法:FDA目前認可的AAMI/ANSI ES60601-1 Medical electrical equipment - Part 1:General Requirements for Basic Safety and Essential Performance以及IEC 60601-2-33 Medical electrical equipment - Part 2-33:Particular requirements for the basic safety and essential performance of magnetic resonance equipment for medical diagnosis
性能標準:產品在其預期使用環境中能安全運行

●試驗名稱:生物相容性終點(由CDRH生物相容性指南確定)
方法:FDA目前認可的生物相容性標準版本
性能標準:產品和產品專用器械的所有直接或間接接觸組織的部件均應確定為具有可接受的生物反應水平。
性能標準來源:CDRH生物相容性指南

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

醫療器械注冊費是行政性收費,按照注冊單元收取,部分省份不收取醫療器械注冊費用,絕大部分省份還是收取的。本篇文章統計了截止到2022年1月5日各地醫療器械注冊收費標準。

近日美國食品藥品監督管理局(FDA)更新了《醫療器械提交的反饋申請和會議申請:Q-Submission指導原則》。此文件是對2019版Q-sub指導原則的更新,更新的主要內容如下:1. 增加了STeP醫療

一個產品帶有CE 標志(標記) 也就意味著其制造商宣告:該產品符合歐洲的健康、安全、與環境保護之相關法律中所規定 的基本要求。因而該產品是對:使用者(譯者注:人)、寵物(

國家藥監局器審中心關于發布定性檢測體外診斷試劑分析性能評估等6項醫療器械產品注冊審查指導原則的通告(2022年第36號) 發布時間:2022-09-28 為進一步規范定性檢測體外診斷試劑分析

自美國總統更替以來,中美雙方交替制裁,接觸FDA 510K申請的朋友也許留意到,近一兩年FDA在評審510K文件時,提出的問題越來越尖銳。聯系到近兩年的中美關系變化,例如美國打壓華為、前兩天

申辦方/CRO有意向在我院開展臨床試驗項目時,需要提交相關材料與臨床研究管理部進行意向溝通。遞交材料包括臨床試驗意向溝通信息登記表(附件)、NMPA臨床試驗批件/溝通函、方案摘要

為進一步規范醫療器械生產現場檢查工作,指導相關企業加強醫療器械生產質量管理,省局組織編寫了《山東省醫療器械潔凈室(區)現場檢查指南》《山東省醫療器械工藝用水現場檢

美國食品藥品監督管理局FDA宣布,其計劃采用ISO13485標準作為其質量體系立法的基礎。FDA如采用ISO13485標準替代其現有的質量體系法規,則代表該標準的認可度獲得進一步的提高,已經成
2019年醫療器械標準宣貫計劃 序號 宣貫標準編號 宣貫標準名稱 時間 地點 技委會或歸口單位 及聯系電話 1 GB/T 22576.1-2018 醫學實驗室 質量和能力的要求 第1部分:通用要求 2019年9月 北京

YY 9706.274-2022《醫用電氣設備 第 2-74 部分:呼吸濕化設備的基本安全和基本性能專用要求》等3項醫療器械行業標準已經審定通過,現予以公布。標準編號、名稱、適用范圍和實施日期見
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
