FDA指南|磁共振線圈產品性能接受標準
FDA于2020.12.11發布了關于簡短(Abbreviated) 510(k)申請的相關產品指南,該指南是在遵守“基于安全有效性途徑”這一前提下編制提出的。在這個框架下,申請人若計劃使用安全有效性途徑提交
來源:醫療器械注冊代辦 發布日期:2023-10-10 閱讀量:次
?
近日美國食品藥品監督管理局(FDA)更新了《醫療器械提交的反饋申請和會議申請:Q-Submission指導原則》。此文件是對2019版Q-sub指導原則的更新,更新的主要內容如下:
1. 增加了STeP醫療器械安全技術計劃的Q-Sub形式;海河在1月8日發布的公眾號文章已經和大家分享了FDA新的審核項目STeP。本次Q-Sub指導原則的更新也是為配套新的審核項目提供的新的反饋機制。
2. 增加了信息會議此類Q-Sub其他適用形式的舉例。

雖然更新的內容很少。但是Q-Sub指導原則本身就是一份很重要的文件,它就不同的提交項目向申請人提供了與FDA進行溝通的可行機制。下面我們就來看一下,Q-Sub指導原則的幾個重要的部分。
Q-Sub包含A,B,C,D 4種常見溝通類型。另外還有適用于FDA已發布的各種交互類審核項目的交互跟蹤機制,我們稱之為E類型溝通機制。除此之外的溝通項目,在FDA還未提供新的溝通機制之前,FDA建議使用信息會議的方式進行交互跟蹤,我們稱之為F類型溝通機制
預提交程序指的是正式上市前申請文件提交前,申請者向FDA提供預審核資料,就某些具體問題提出反饋請求。該途徑可以讓FDA提前審核臨床和/或非臨床研究的方案以及其他可能的關鍵信息,申請人在獲得FDA反饋后可以在研究方案中盡可能的考慮FDA的意見。這樣可以有利于提高后面正式遞交文件的質量。
適用的提交項目:
上市前申請包括臨床實驗器械豁免IDE, 上市前批注PMA,人道主義器械豁免申請HDE,自動評定類申請DeNovo request, 上市前準許510(k),Dual 510(k), 生物制劑許可申請BLA,實驗性新藥申請IND,附件分類請求,臨床實驗室改進修訂(CLIA)豁免申請
SIRs指的是在已提交正式文件并收到FDA的發補意見的情況下,申請人可以通過SIR與FDA溝通發補問題的解決思路,從而加快正式文件的審核進度。這個途徑類似于我們國家的補正資料預審查機制。需要申請人注意的是,在SIR中,FDA僅會就問題解決思路提出反饋意見,而不會審核任何測試相關的數據以及問題的回復。
適用的上市前申請包括:
1)自動III類器械指定(De Novo request),上市前準許510(k),Dual 510(k)及實驗室改進修訂豁免申請項目中hold letter里的問題;
2)PMA和HDE項目中的重大缺陷、不被批準、有缺陷的批準、待批準的GMP和PAS條件的批準;
3)BLA申請的完全答復信函。
研究風險確定指的是申請人要求FDA確定處于計劃中的醫療器械的臨床研究是否為重大風險(SR),非重大風險(NSR)或可IDE豁免。對于非IDE豁免研究,申請人有責任進行初步風險判定(SR或NSR)并將其提交給機構審查委員會(IRB)。FDA可幫助申請人以及臨床研究者和IRB進行風險判定,并可以最終裁決臨床研究是重大風險還是非重大風險。
信息會議指的是申請人可以自愿通過會議的方式與FDA分享產品研發過程中的信息,從而使FDA熟悉這個新產品。因為只是分享的目的,所以并不需要FDA給出反饋。這個機制適用于在接下來的6~12個月內有多次提交計劃的申請人。信息會議可以讓FDA了解與當前可用技術存在重大差異的新設備。
信息會議還可以用于記錄FDA和申請人之間的交互,但這種交互不屬于本D溝通類型,而屬于下文提到的F信息會議的另外一種使用方法。
除了上面列出的4種Q-Sub類型之外,下列交互活動的跟蹤也屬于Q-Sub。這些交互活動的政策及程序可以在各自的指導文件中找到。
1)“交互程序100天會議及后續缺陷指導原則”中規定的PMA 100天會議;
2)“根據FDA現代化法案(FDAMA)進行的早期合作會議”指導原則中描述的協議和確定會議;
3)“突破性器械計劃”指導原則中描述的與突破性器械計劃相關的提交內容
4)“安全技術計劃”指導原則中描述的與安全技術計劃相關的提交內容
5)“醫療器械附件-描述附件和分類途徑”指導原則中描述的附件分類需求
一些不符合以上5個Q-Sub類型的特殊類型的交互方式,在FDA還沒有為它們建立新的Q-Sub方式之前,FDA可能采用信息會議的方式跟蹤這些交互。不同于D類型溝通方式,這種溝通機制是可以要求FDA提供反饋的。例如:
1)其他政府機構、非營利組織、貿易組織和專業協會就特定問題或跨領域政策事項(例如,與特定的上市前申請無關的提交策略,第三方測試實驗室的非臨床測試策略)向FDA提出反饋請求;
2)有關醫療器械開發工具的反饋請求;
3)有關認可可公開訪問的遺傳變異數據庫的反饋請求;
4)有關臨床研究的設計要素的反饋請求,并且這些反饋請求不屬于Pre-sub的范疇。這些請求可能包括有關NSR或IDE豁免研究的研究設計的反饋,這些研究的結果并非旨在支持后續的IDE或上市申請。
5)FD&C法案第503(g)(2)(A)條所定義的組合產品協議會議(CPAM)。
6)與合規行為有關的FDA反饋請求。例如,信息會議Q-Sub可用于請求FDA給出FDA 483表中列出的檢查觀察項的反饋,以幫助申請人準備回復文件。
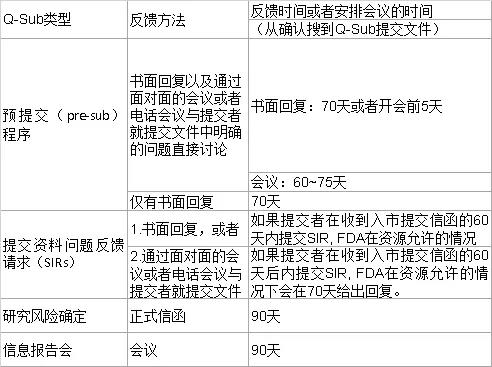
此外,還需要注意的是在這份新的Q-Sub的指導原則中,FDA給出的反饋時間表與之前的并沒有差別。但是根據海河最近與FDA的溝通,為了應對疫情,FDA不得不將很多資源都分配給應對新冠病毒的相關業務上,所以從2020年10月份開始,FDA對于收到的Pre-sub的回復時間開始有普遍性的延遲,最快也要120天后才能對相關Pre-sub文件進行實質審核。


站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

FDA于2020.12.11發布了關于簡短(Abbreviated) 510(k)申請的相關產品指南,該指南是在遵守“基于安全有效性途徑”這一前提下編制提出的。在這個框架下,申請人若計劃使用安全有效性途徑提交

一個產品帶有CE 標志(標記) 也就意味著其制造商宣告:該產品符合歐洲的健康、安全、與環境保護之相關法律中所規定 的基本要求。因而該產品是對:使用者(譯者注:人)、寵物(

國家藥監局器審中心關于發布定性檢測體外診斷試劑分析性能評估等6項醫療器械產品注冊審查指導原則的通告(2022年第36號) 發布時間:2022-09-28 為進一步規范定性檢測體外診斷試劑分析

自美國總統更替以來,中美雙方交替制裁,接觸FDA 510K申請的朋友也許留意到,近一兩年FDA在評審510K文件時,提出的問題越來越尖銳。聯系到近兩年的中美關系變化,例如美國打壓華為、前兩天

物理治療器械是近年醫療器械注冊主流產品之一,近日,醫療器械標準管理研究所發布關于對物理治療器械等領域通用名稱命名指導原則征求意見的通知,面向社會公眾公開征求意見。

為加強醫療器械產品注冊工作的監督和指導,進一步提高注冊審查質量,國家藥品監督管理局組織制定了《一次性使用高壓造影注射器及附件產品注冊審查指導原則》《金屬接骨板內固

為加強醫療器械產品注冊工作的監督和指導,進一步提高注冊審查質量,國家藥品監督管理局組織制定了《關節鏡下無源手術器械產品注冊審查指導原則》《一次性使用輸尿管導引鞘注

美國食品藥品監督管理局FDA宣布,其計劃采用ISO13485標準作為其質量體系立法的基礎。FDA如采用ISO13485標準替代其現有的質量體系法規,則代表該標準的認可度獲得進一步的提高,已經成

為加強醫療器械產品注冊工作的監督和指導,進一步提高注冊審查質量,國家藥品監督管理局組織制定了《體外膜氧合(ECMO)循環套包注冊審查指導原則》《一次性使用腹部穿刺器注冊

為加強醫療器械產品注冊工作的監督和指導,進一步提高注冊審查質量,國家藥品監督管理局組織制定了《醫療器械動物試驗研究注冊審查指導原則 第一部分:決策原則(2021年修訂版)
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
