有源醫療器械加速老化試驗效期驗證及使用期限驗證流程
為了確保醫療器械在生命周期內的安全及有效性,注冊人應在設計開發中對其使用期限予以驗證。使用期限的驗證是醫療器械可靠性研究的重要組成部分,制定并驗證合理的使用期限有
來源:醫療器械注冊代辦 發布日期:2021-08-22 閱讀量:次
原創:小藥丸
9月18日,國家藥品監督管理局發布通告,出臺了《晚期非小細胞肺癌臨床試驗終點技術指導原則》,旨在規范和指導我國治療晚期非小細胞肺癌藥物的臨床試驗設計和終點選擇,提供可參考的技術規范。《原則》所涉及的觀點代表了當前NMPA對晚期NSCLC臨床試驗設計和終點選擇的審評認識,適用于支持晚期NSCLC適應癥注冊的臨床試驗設計及終點選擇,NMPA鼓勵研發從業人員探索科學創新的終點和試驗設計,并及時與NMPA的審評部門溝通和交流。
肺癌是中國和世界范圍發病率最高的癌癥,據統計,2015年中國新發肺癌病例約78.7萬人,死亡63.1萬人。其中,非小細胞肺癌(NSCLC)約占肺癌總體的85%。
早期肺癌患者預后較好,但由于肺癌確診時多數患者分期較晚,肺癌患者整體的五年生存率僅20%左右,生存率亟待提升,整個肺癌領域尚存在較大的臨床需求未被滿足。
從1997年EGFR抑制劑進入臨床到目前多個藥物一線治療地位的確立,經歷了20多年的時間。
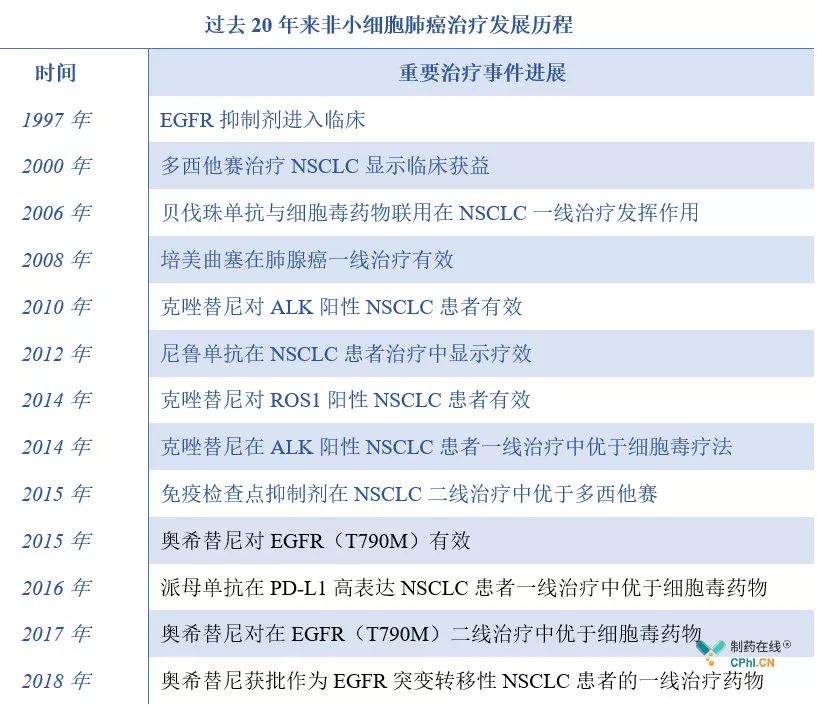
數據來源:公開資料整理
2018年,國內新增了320項腫瘤臨床試驗,同比增長56%,其中新增I期臨床試驗數量149個、新增II期臨床試驗數量69個、新增III期臨床試驗數量98個。新增試驗共招募患者規模達到49517人,涉及到293個藥物。
按照腫瘤種類分類,非小細胞肺癌的新增臨床試驗數量最多,達到47項,招募患者人數9116,試驗人數最多,遙遙領先于其他瘤種。
就整體的臨床治療而言,現階段晚期NSCLC的治療目標是延長患者生命,提高生活質量。
總生存期(OS)是反映NSCLC患者生存獲益的直接終點,其臨床意義重于無進展生存期(PFS)等替代終點。在后續治療均衡的情況下,現階段國內外專家考慮認為,在轉移性肺鱗癌中,2.5個月以上OS獲益被認為具有顯著的臨床價值,非鱗癌中3.25個月以上的OS獲益被認為具有顯著的臨床價值,目標HR的點估計值通常不高于0.80。通常將風險比和中位獲益結合評價,認為兩者均達到具有更穩健的OS獲益。
近年來,小分子酪氨酸激酶抑制劑、抗血管生成藥物和免疫檢查點抑制劑的應用已顯著提高了NSCLC患者的生存,是現階段主要的三大類型治療藥物。
EGFR-TKI是目前治療EGFR突變陽性NSCLC患者的最有效藥物,截止目前EGFR-TKI已開發至第三代。代表性藥物為2015年上市的三代 EGFR-TKI奧希替尼,憑借優異的臨床療效目前已經成為EGFR突變NSCLC一線治療的新標準。未來,EGFR-TKI通過與化療藥物聯合使用,進一步延長晚期NSCLC患者的生存期是這類藥物發展的主要方向之一。
目前,用于NSCLC患者治療常見的抗血管生成藥物為貝伐珠單抗、雷莫蘆單抗及安羅替尼。2018年5月,正大天晴安羅替尼經國家藥品管理局批準上市,用于既往至少接受過2種系統化療出現進展或復發的局部晚期或轉移性非小細胞肺癌患者的治療,成為全球首個用于肺癌治療的抗血管生成藥物。
除了單藥用于非小細胞肺癌的治療之外,臨床研究顯示,抗血管生成小分子靶向藥與PD-1/PD-L1單抗具有很好的協同效應,聯合使用可進一步延長這類小分子靶向藥的生命周期。
肺癌是免疫檢查點抑制劑PD-1/PD-L1單抗的重要適應癥之一,這類藥物最早用于肺癌的二線治療,海外Checkmate-017、Keynote-010、OAK及中國Checkmate-078等臨床研究相繼證明了PD-1/PD-L1單抗用于NSCLC二線治療的臨床獲益。
從總體上來看,PD-1/PD-L1單抗單藥治療的有效率較低,短期療效不顯著,但患者的長期療效獲益顯著。與其他藥物聯合使用,并尋找合適的生物標記物甄選目標治療人群、提升療效是這類藥物未來發展的重要方向。
臨床試驗合作,請咨詢18603823910。
轉載自新浪醫藥新聞,*聲明:本文由入駐新浪醫藥新聞作者撰寫,觀點僅代表作者本人,不代表新浪醫藥新聞和思途醫療器械CRO立場。

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。
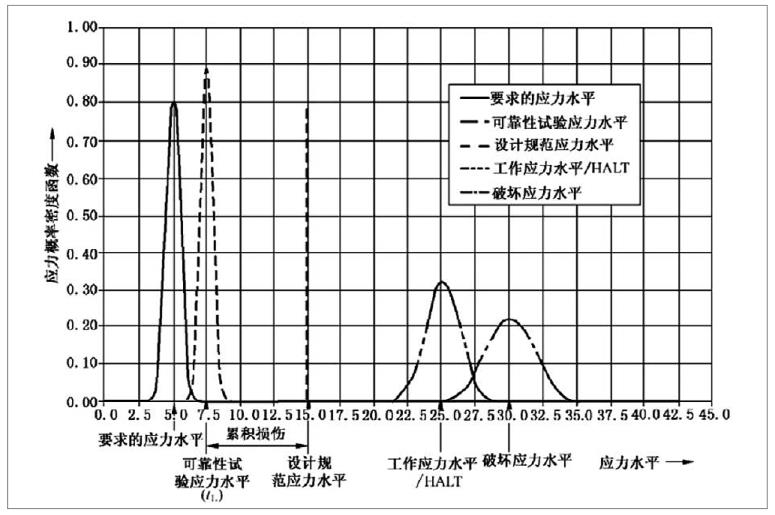
為了確保醫療器械在生命周期內的安全及有效性,注冊人應在設計開發中對其使用期限予以驗證。使用期限的驗證是醫療器械可靠性研究的重要組成部分,制定并驗證合理的使用期限有

簡述了中藥新藥臨床試驗主要特點,指出要重視風險、受益評估,重視人 用經驗選擇科學、客觀、合適的有效性指標,做好中醫證候療效評價,鼓勵在中藥新藥臨床研究中采用電子化手

按照中共中央辦公廳和國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號)和《國務院關于修改〈醫療器械監督管理條例〉的決定》(

近日美國食品藥品監督管理局(FDA)更新了《醫療器械提交的反饋申請和會議申請:Q-Submission指導原則》。此文件是對2019版Q-sub指導原則的更新,更新的主要內容如下:1. 增加了STeP醫療

體外診斷試劑臨床試驗數據造假行為,怎么處罰?本文針對體外診斷試劑注冊環節的臨床試驗數據造假行為,一起來看看懲罰力度。

為進一步規范體外診斷試劑的管理,國家藥監局器審中心組織制定了《人類SDC2基因甲基化檢測試劑臨床試驗資料技術審評要點》、《異常凝血酶原測定試劑臨床試驗資料技術審評要點》
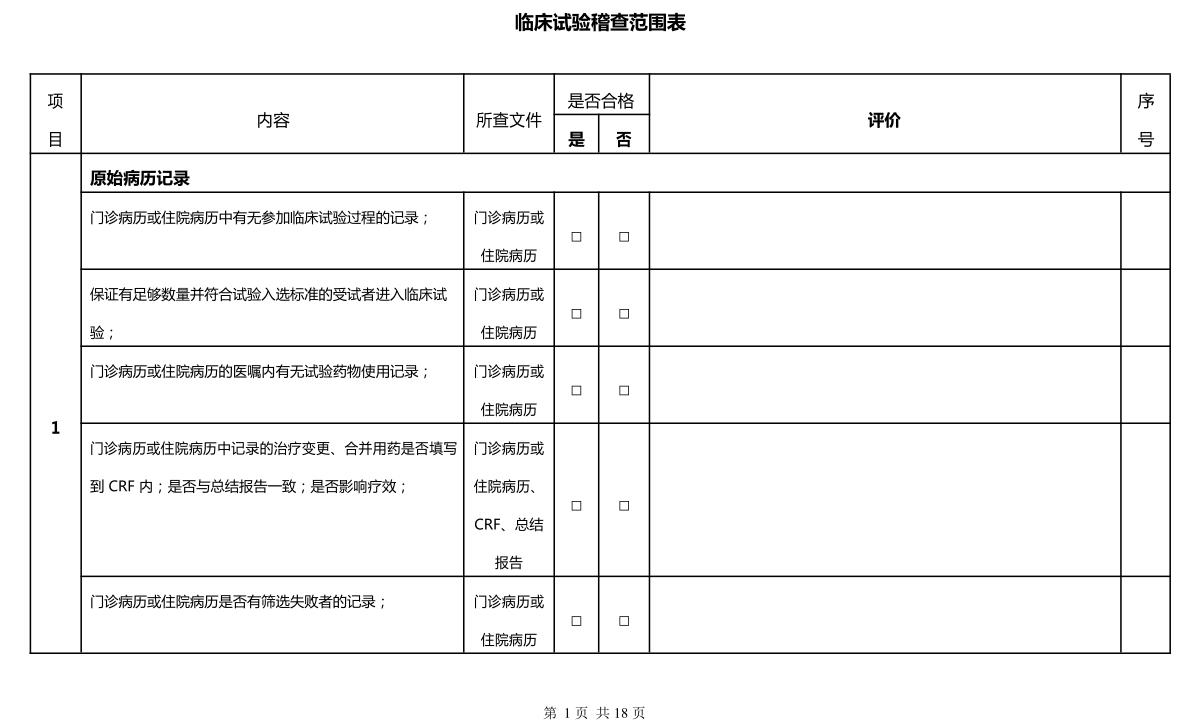
臨床試驗第三方稽查公司不少,思途就是其中之一。在稽查時,相關人員要明確稽查范圍,讓臨床試驗更真實化、合規化。本文將思途在給客戶做稽查時的稽查表分享出來,文末供下載

國家藥監局器審中心關于發布定性檢測體外診斷試劑分析性能評估等6項醫療器械產品注冊審查指導原則的通告(2022年第36號) 發布時間:2022-09-28 為進一步規范定性檢測體外診斷試劑分析
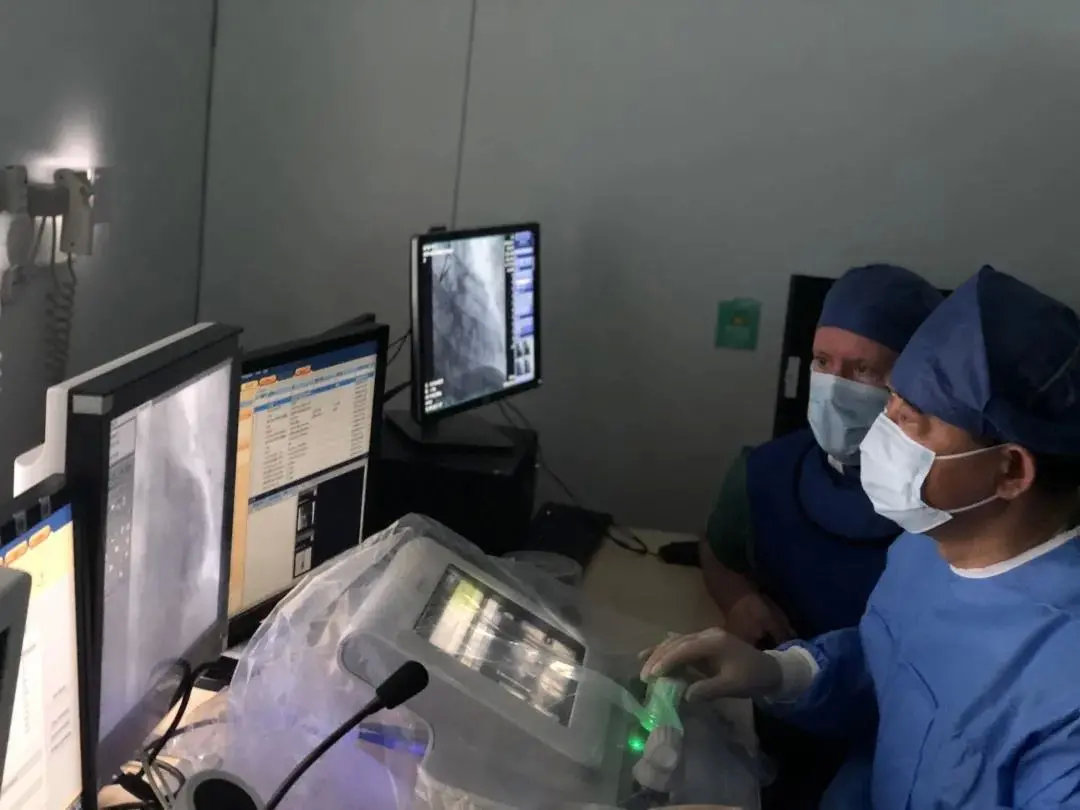
3月13日,西門子醫療Corindus途靈?最新一代CorPath?GRX介入手術機器人在海南博鰲超級醫院完成其國內首例機器人輔助下冠狀動脈介入治療(PCI)手術,手術由中國科學院院士、復旦大學附

物理治療器械是近年醫療器械注冊主流產品之一,近日,醫療器械標準管理研究所發布關于對物理治療器械等領域通用名稱命名指導原則征求意見的通知,面向社會公眾公開征求意見。
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
