臨床試驗中的單盲、雙盲、三盲、破盲是什么意思?
盲法試驗常用的有兩種:單盲(single blinding)和雙盲(double blinding),更嚴格的對照試驗要用到三盲(triple blinding),在對照藥物和試驗藥物劑型或外觀不同時,還要用到雙盲雙模擬技
來源:醫療器械注冊代辦 發布日期:2024-06-13 閱讀量:次
藥物臨床試驗必須遵循 GCP原則、依從倫理委員會批準的試驗方案; 任何有意或無意偏離或違反GCP原則和試驗方案的行為叫做偏離方案(protocol deviation,PD) 或違背方案( protocol violation, PV) 。
ICH GCP 對于偏離方案的規定[2]是: 研究者/ 研究機構應當依從由申辦者同意、管理當局(如有要求)批準,并已獲得倫理委員會批準的試驗方案。研究者/研究機構和申辦者應在試驗方案或類似的合同(如在美國,研究者要求簽署 FDA1572 表) 上簽字以確認對方案的依從。如沒有和申辦者達成一 致并事先得到倫理委員會的審查和書面同意,研究者不能有任何偏離方案的行為,除非必須立即消除對受試者的傷害,或只是涉及事務上的或管理方面 的變化(如監查員變更,電話號碼的變更)。研究者/研究機構或申辦者方面有不依從方案/SOP/現行法規的行為時,申辦者應立即采取措施以保證對方案的依從。
方案偏離(Protocoldeviation,PD)
在研究者控制下的、未經IRB批準的研究方案的試驗設計或程序的任何變化、分歧或者背離。
方案違背(Protocolviolation,PV)
方案違背是違反IRB批準的方案,它可影響到受試者的權益、安全性和獲益,或研究數據的完整性、精確性和可靠性。
一是方案設計的原因。包括方案對入選標準或者排除標準的設計不合理;設計的隨訪未留時間窗或者時間窗過短;臨床試驗相關檢查設計不合理;臨床試驗流程設計不合理等。
二是研究者方面的原因。主要是研究者對方案理解不深,未按照試驗方案操作實施,出現檢查漏開、受試者隨訪丟失、隨機流程操作錯誤等情況。
三是受試者依從性差。這是臨床試驗操作過程中,普遍存在的問題,表現為受試者未按時回院隨訪、不遵醫囑服用藥物或者使用醫療器械。
四是申辦方的原因。因為申辦方未及時提供有關資料、工具等造成的。例如器械項目中,可能出現器械缺陷未及時處理的情況。
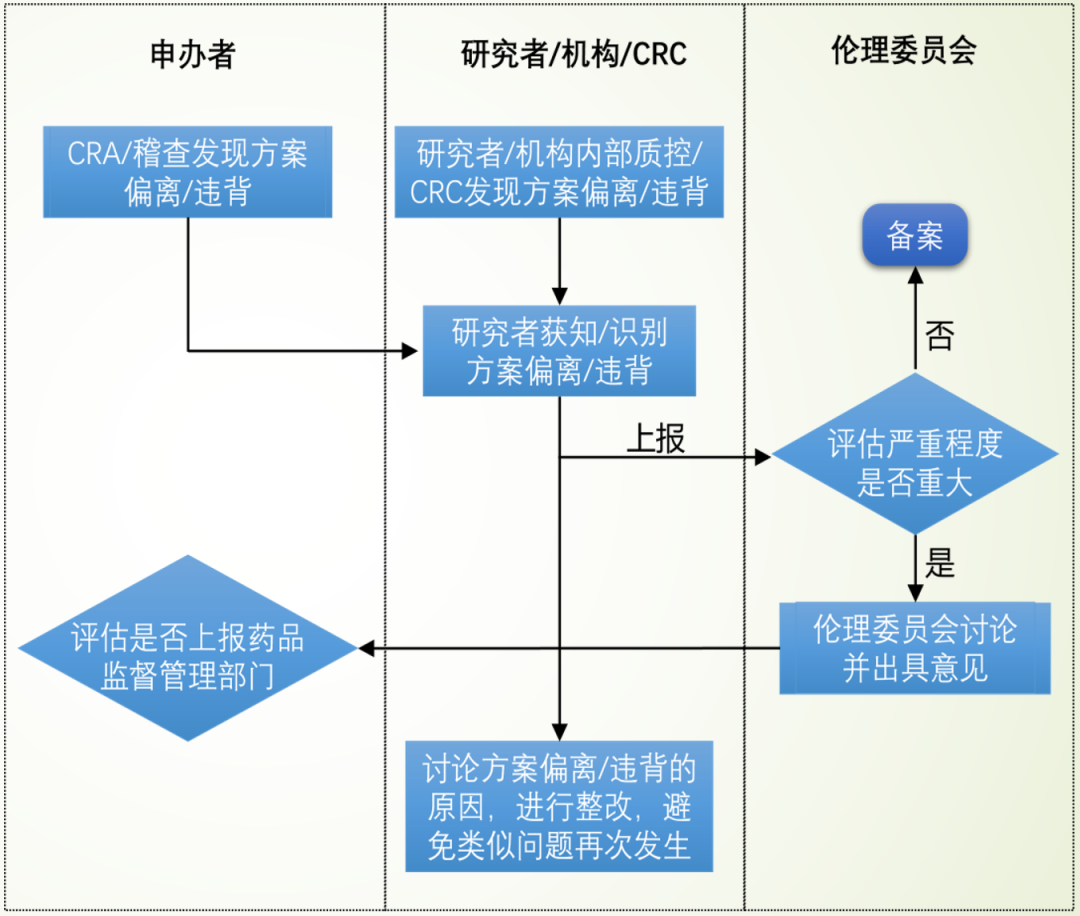
1、研究者向申辦者報告;
2、研究者/申辦者向倫理委員會報告;
3、向政府藥品監督管理部門報告:申辦者在臨床總結報告中報告;申辦者將重大/持續PD 發生后中止了研究者/研究機構參與試驗的情況上報;研究者上報嚴重PD。
Tips
1、一般來說,如果是輕微 PD,CRA 要做好記錄,和 PI 溝通和培訓,并在監查報告上體現,上報給上級,這是監查員的職責,即①;
2、申辦方匯總,定期向倫理報告,即②;
3、重大 PD,處理需要向申辦方匯報,申辦方如判定這是嚴重 PD 的話,需要通報PI 和通報倫理;視嚴重程度,選擇進行步驟③。
Critical Protocol Deviation: A deviation from Protocol-related procedures that threatens integrity of data, adversely affects subjects and/or could invalidate acceptability of a project (or part of it). Such deviations require immediate action.
偏離方案相關程序,威脅數據的完整性,對受試者產生不利影響和/或可能使項目(或部分項目)的可接受性失效。這種偏差需要立即采取行動。
Major Protocol Deviation: A deviation from Protocol-related procedures that could affect integrity of the data or adversely affect subjects. Such deviations require timely action.
偏離方案相關程序,可能影響數據的完整性或對受試者產生不利影響。這種偏差需要及時采取行動。
Minor Protocol Deviation: A deviation from accepted procedures that will not adversely affect subjects or data integrity but should be dealt with appropriately.
偏離公認程序,不會對受試者或數據完整性產生不利影響,但應適當處理。
Must be measurable so that any person reading the information (site manager/CRA, site staff, PM/COL, Sponsor, etc.) will know exactly what is meant and root cause:
1、WHO(which Subject or investigator is involved)
2、WHAT(objectively describe the content of the protocol deviation, from a thirdpersonperspective)
3、WHEN(which visit is involved and indicate date)
4、WHY(indicate the root cause, and objectively analyze the occurrence of the protocol deviation)
5、WHERE(indicate the place where the protocol deviation occurred, such as the site number involved, the relevant department, or the subject himself, etc.)
Minor PD: Subject 1000X00X local chemical testing result for week 16 visit was reported at 12:04 am on 09Feb2022(ALT/AST results were normal), however the IP was randomly assigned at 08:33 am and administered at 09:56 am on 09Feb2022. Root cause: that was because the investigators (name) ignored a protocol requirement that dosing should be started after all safety evaluation were available.
Major PD: The subject performed the week 16 visit on 01Apr2022. Due to the error of IXRS system operation, the IP for Week12 was randomly assigned and injection to this subject. Root cause:1. Week 12 was skipped due to the impact of the epidemic, but the site staff did not register "SKIP" in the IWRS system. As a result, the visit of Week 12 was wrongly registered in the system when Week 16 visited, and drugs of Week 12 were used. 2. Sub-idid not review the IP number in a timely manner after the randomization and before the subject took the IP.
Action Items must be measurable/executable so that any person reading the information (site manager/CRA, site staff, sponsor, Auditor, etc.) will know exactly what is meant and take the action accordingly:
1、WHO (Roll or Roll+ full name) is responsible for the action?
2、WHAT exact action is required?
3、WHEN should the AI be resolved?
Example:
The new sub-Investigator, Dr. Smith (who), will need to sign the delegation log (what) as soon as possible and no later than 01Sep2013 (when).
For the Action Item owner (WHO): “site staff” or role (e.g. SC.) is acceptable.
Only name without the person role, is not acceptable Each Subject-specific Action Item must include: - Subject and visit identification - Outstanding issue and responsible party (Dr. Smith (Sub-I) or Ms. Jones (SC)
Example:
SC or Dr. Smith (Sub-I) to re-consent the Subject 100123/ABC on the latest Informed Consent (version 2.1;15Sep2013) at the subject next scheduled visit (Visit 4 on 01Oct2013).
CRA should ensure that all the PD end date is added.
PD end date is the date that deviation has ended, it can same day as PD happened date or after the PD start date.
For example:
if a PD is subject visit out of window, the PD start date should be the last planned date of this scheduled visit, and the PD end date is the actual date the subject completed visit.
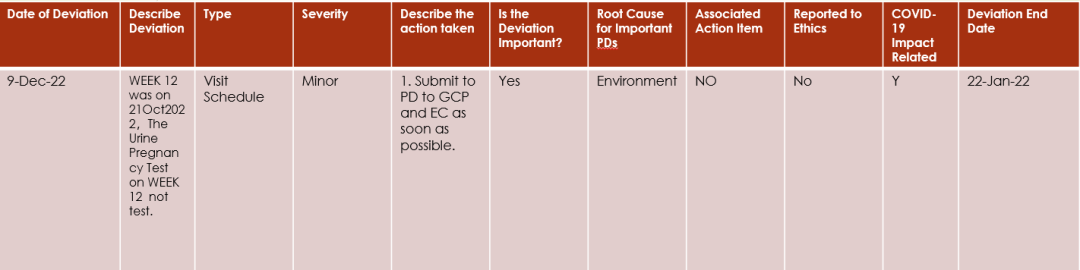
1、Start date error,The end date then precedes the start date。
2、Subject number needs to be added。
3、add how the investigator confirmed that the subject was not pregnant during the visit.
4、as per the protocol the urine/blood pregnancy test is required;
5、Type should be Laboratory Assessment
6、add EC submission expected date or specific date (DD-MMM-YYYY, or before the end of MMM-YYYY, etc.)
7、add the action on providing the relevant training to investigator;
8、Root Cause for Important PDsshould be Site Staff Error
9、Not yet submitted to EC and GCP should open an AI
10、The information needs to be updated again after completing the submission
作者:張遙

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

盲法試驗常用的有兩種:單盲(single blinding)和雙盲(double blinding),更嚴格的對照試驗要用到三盲(triple blinding),在對照藥物和試驗藥物劑型或外觀不同時,還要用到雙盲雙模擬技

剛接觸CRO行業的小伙伴,在學習文件法規資料的同時,常看到一些英文類專業名詞不知道是什么意思。下面,一起看看常見的臨床試驗專業術語: CRO行業的常用術語解釋: 1:新藥研發

SSU是Study Start Up的縮寫,從最初的項目準備,到啟動訪視(Site Initiation Visit)之前所有的準備工作,對整個臨床研究項目的啟動非常關鍵。負責這個關鍵階段工作的部門人員,就叫做SS

醫學的進步是以研究為基礎的,這些研究在一定程度上賴于以人作為受試者的試驗。--《赫爾辛基宣言》。Ⅰ期臨床研究目的是確定可用于臨床新藥的安全有效劑量與合理給藥方案。根據
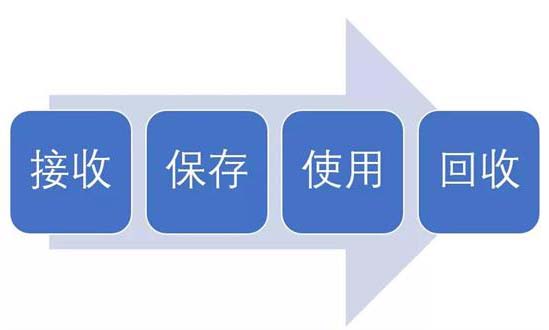
試驗用藥品是指用于臨床試驗的試驗藥物、對照藥品。試驗用藥品滲透到了臨床試驗過程中的每一個步驟,包括藥物的生產、包裝、運輸、保存、使用、回收等。今天我們從臨床試驗中

不少二三類需要臨床的產品,客戶一聽到臨床報價就退縮。既然這么貴,還不如自己做......事實真的是這樣嗎?臨床報價費用都由哪些組成?費用都誰收走了?自己做又有哪些風險?文

隨著醫療器械出口的日益增長,根據市場的需求各醫療器械生產廠商需要符合國家和地區的質量體系法規越來越多,所以經常會碰到出處于不同法規或標準的一些比較容易混淆的概念及

俗話說“知己知彼,百戰不殆”,對于作為CRC的我們,自認為對CRA其實已經很了解了,但是在我們工作過程有一個角色平時接觸不到,但是卻又繞不開躲不過,尤其是面對滿屏EDC query的

大多數CRO公司在臨床試驗現場啟動會(SIV)上,常由CRA主導。作為一名有上進心的CRA必須清楚的了解到臨床試驗現場啟動考察的流程,再分享一些本人在啟動會考察的細節,請看下文。

在臨床試驗中,無論是監查員、質控人員或者項目管理人員到研究中心查看項目資料的時候,總會多多少少發現一些問題,有些問題可能大家都比較熟知,但處理手法五花八門的。處理
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
