消毒產品有哪些?消毒產品分類/備案依據和備案資料要求
根據《中華人民共和國傳染病防治法》第七十八條的規定,消毒是指用化學、物理、生物的方法殺滅或者消除環境中的病原微生物。 在作用目的上,它是一種防病的產品,而不是
來源:醫療器械注冊代辦 發布日期:2024-09-13 閱讀量:次
在臨床試驗中,不良事件(Adverse Event, AE)的監測和評估是確保受試者安全的重要環節。為了更好地理解和管理AE,通常會對AE進行分級,并根據一定的標準來判定AE的發生。本文將詳細介紹AE的分級及判定依據。

AE可以根據其嚴重程度分為不同的等級,常見的分級方式有兩種:
這種分級方式較為直觀,適用于一般情況下的不良事件分類。輕度AE指的是對受試者日常生活影響較小,無需特殊處理或僅需簡單處理即可恢復的不良事件;中度AE則是指需要采取一定的醫療干預措施才能緩解的不良事件;重度AE則是指對受試者健康構成嚴重威脅,需要緊急處理的不良事件。
NCI-CTC(美國國立癌癥研究所-常見毒性標準)是一種更為詳細的AE分級標準,常用于癌癥臨床試驗中。根據這一標準,AE被劃分為五個等級:
1級(輕微):不良事件存在但對受試者日常生活影響不大,一般不需要特殊處理。
2級(中度):不良事件對受試者日常生活有一定影響,需要采取一定的醫療干預措施。
3級(重度):不良事件嚴重影響受試者日常生活,需要立即采取醫療措施。
4級(危及生命):不良事件危及受試者生命安全,需要緊急處理。
5級(致命):不良事件直接導致受試者死亡。
判定AE的依據主要包括以下幾個方面:
如果受試者在試驗過程中原有的癥狀或體征有所加劇,例如頭痛加劇、惡心嘔吐頻率增加等,這些變化都可能被視為AE的表現。
如果在試驗過程中出現了新的疾病診斷,比如感染性疾病、心血管事件等,這些新發疾病也可能被歸類為AE。
通過實驗室檢查發現的異常結果,如血液生化指標異常、血細胞計數異常等,這些異常結果如果與受試者在接受試驗藥物后的生理變化相關,也可能被判定為AE。
受試者在試驗過程中出現的任何新的不適癥狀,如皮疹、肌肉疼痛等,都應被記錄并評估是否為AE。
AE的分級和判定是臨床試驗中非常重要的環節,它直接關系到受試者的安全和試驗數據的可靠性。通過對AE進行科學的分級,并依據原有癥狀、體征的加重、新診斷的疾病、實驗室異常值及新出現的癥狀來判定AE,可以更準確地評估藥物的安全性,為受試者的健康提供保障。希望本文能夠幫助讀者更好地理解AE分級及判定的依據,從而在臨床試驗中更加科學地管理和應對AE。

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

根據《中華人民共和國傳染病防治法》第七十八條的規定,消毒是指用化學、物理、生物的方法殺滅或者消除環境中的病原微生物。 在作用目的上,它是一種防病的產品,而不是

在過去幾年的工作中,我發現SAE上報既是臨床試驗工作中的重點難點,也是CRC工作中的痛點。當你是小白時,看到SAE就很頭大,天然地產生一種畏懼心理,談SAE色變,當你經驗比較豐富
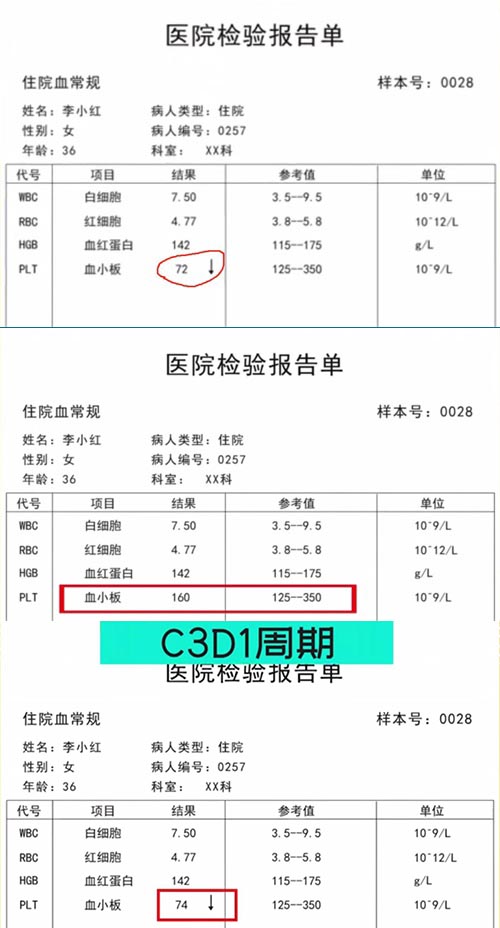
某乳腺癌項目012號受試者,基線期血小板計數降低II級,研究者判斷有臨床意義,并將血小板計數降低記錄在病史之中。C2D15周期用藥前實驗室檢查顯示恢復了正常水平,然后在C3D1周期用
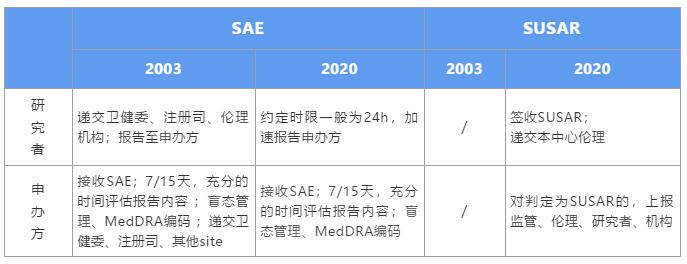
新版GCP對于申辦方的影響是全方位的,就SAE個例報告處理方面,強化了申辦方的主體責任,細化了申辦方對SAE的管理流程。在此,我們詳細解讀,在新規之下,該如何高效、合規的處理

新版GCP的SAE/SUSAR怎么上報?先來了解一下什么是SAE?什么是SUSAR?跟隨小編的腳步一起看看SAE和SUSAR的關系,最后再來探討上報。正文如下:

醫療器械注冊檢驗的依據,業內應該都比較統一,如果是第一次接觸還真不知道是什么?一起來看看依據的哪個法規。醫療器械注冊檢驗的依據是什么?抗HPV婦科凝膠在醫院銷量特別好

不良事件相關性判定,基于什么原則來考慮?參考研究者手冊?去激發、再激發?七分、六分、五分、二分...為什么相關性判定的分級方式不同, 哪一種才是權威的?眾多相關性判定方
在眾志成城,共克時艱,全國人民攜手抗擊新冠肺炎疫情的時候,臨床試驗領域也面臨著諸多挑戰!為了保證疫情防控下的受試者安全,各醫療機構和申辦方/CRO都對臨床試驗工作的有序

上期分享了CRC在臨床啟動會中文件簽署不全或丟失的處理方法,本期為了平衡CRC的感受......哈哈,我們研究一下CRA監查時偶遇問題,在愜意的假期時光,抽出寶貴的兩分鐘,來溫習一個

不管是在中國還是國外,都有方案將AE的開始收集時間定義為簽署ICF之后就開始收集,而不是等到首次研究治療/干預/用藥。根據檢索相關信息,這一設定的考量可能包括以下幾點(從臨
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
